►1885 : Pasteur met au point la première vaccination contre la rage → utilise une particule virale.
►1892 : Ivanowski découvre le virus de la mosaïque du tabac (premier virus végétal identifié).
►1915-1917 : Découverte des premiers bactériophages (virus infectant les bactéries, comme Shigella dysenteriae).
Certains virus possèdent la propriété de s’intégrer dans le génome de l’hôte grâce à une intégrase.
Ex : le VIH qui se fond dans le g
•Particularité
La taille :
Taille moyenne : de 20 à 400 nm (ex : Mimivirus = 400 nm). Certains virus géants imitent même des cellules microbiennes.
La forme / architecture :
►3 types de symétries :
- Hélicoïdale : en forme de bâtonnet (ex : virus de la mosaïque du tabac).
- Icosaédrique : forme sphérique à base de triangles (ex : Rhinovirus).
- Binaire : mélange des deux précédentes, typique des bactériophages.
► Virus nus ou enveloppés :
- Nus : seule une capside protéique (ex : papillomavirus, rotavirus).
- Enveloppés : membrane phospholipidique dérivée de l’hôte, enrichie en protéines virales (ex : SARS-CoV-2, VIH).
→ rhume (Rhinovirus), Verrue plantaire (Papillomavirus), Virus de la
gastroentérite (Rotavirus).

• Diversité génomique
Pourquoi on ne parle pas de reproduction ?
→Les virus ne se reproduisent pas, ils se répliquent en détournant la machinerie de l’hôte.
Classification de Baltimore:
Basée sur :
- La nature du génome (ADN ou ARN, simple ou double brin)
- Le mode de réplication.
→ Elle divise les virus en 7 groupes.
• Origine des virus
Hypothèse de l’ARN primitif : un monde à ARN aurait précédé celui à ADN (W. Gilbert).
►Certains virus (ex : PBS1, AR9) utilisent dUTP au lieu de dTTP, montrant une transition possible ARN → ADN
- Synthèse des bases ribonucléotidiques (ARN)
- Réduction des ribonucléotides en désoxyribonucléotides
- Modification du dUTP en dTTP
Seuls quelques virus à ARN possèdent les enzymes capables de
transformer l’ARN en ADN (reverse transcriptase).
►Les virus pourraient être à l’origine de l’ADN cellulaire → très anciens.
►Homologie génétique entre virus infectant les trois domaines du vivant (bactéries, archées, eucaryotes) → origine commune possible avant LUCA.
►on trouve aussi des virus hybrides, possèdent des génomes « intermédiaires » qui ont un ADN modifié.
→virus PBS1 (Bacillus), AR9 (Bacillus) utilisent du dUTP* à la place du dTTP dans leur génome à ADN … Ils ont donc des bases Uracyl alors qu’ils sont à ADN.
Condensation de l'ADN:
petits virus ont la capacité de condenser les gènes, les faire se chevaucher sur une toute petite particule.
→stratégies de traduction inhabituelles pour exprimer l’ensemble de leur patrimoine génétique. Il décale sa lecture pour lire les différentes protéines.
• Cycle infectieux
A. Chez les bactériophages
95% à symétrie binaire
- Phase de reconnaissance : reconnaissance de l’hôte(rencontre sa cellule hôte et vient s’accroche) → absorption + injection de l’ADN.
- Phase d’éclipse : plus de virus détectable, production des composants viraux.
- Phase de maturation : assemblage des virions.
- Libération : par lyse.
----: période de latence

période de latence

schéma résumer
► Deux types de cycles :
- Cycle lytique : réplication immédiate et destruction de la cellule.
- Cycle lysogénique : intégration dans le génome de l’hôte → prophage → activation sous stress.

schéma résumer
B. Chez les virus animaux
Virus nu :
- Entrée par endocytose, libération du génome.
- Sortie par lyse cellulaire → destruction.
Virus enveloppé :
- Fusion avec la membrane plasmique.
- Sortie par bourgeonnement → l’hôte n’est pas détruit.
- Ex : VIH → infection persistante.
La production virale par excrétion→ fusion de l’enveloppe virale avec la membrane cytoplasmique , Sortie par bourgeonnement en volant une partie de la membrane cytoplasmique
Infection latence :
- Pas d’expression immédiate → virus reste caché (ex : Herpès).
- Réactivation possible (boutons de fièvre )
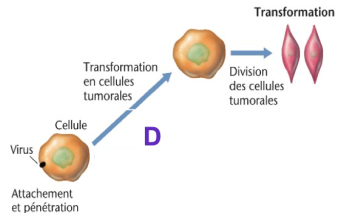
Transformation tumorale :
Certains virus peuvent rendre une cellule tumorale (Ces virus oncogènes induisent des cancers ) :
- EBV (Epstein-Barr virus) → lymphome de Burkitt, mononucléose.
- HPV (Papillomavirus humain) → cancer du col de l’utérus
• Virus à ARN
A) Influenzavirus (grippe) :
- ARN simple brin négatif segmenté (8 fragments)
- Famille : Orthomyxoviridae
- Nécessite une ARN polymérase virale.
- Mutations fréquentes → nouveaux variants chaque année.
- symétrie icosaédrique enveloppé dont le génome est fragmenté en 8 segments d’ARNsb - *
→ donne naissance a des virions =ARN génomique viral ne peut pas être directement reconnu et décrypté par les ribosomes cellulaires car il est « anti-messager »
*(le - signifie que quand le virus se décapside, les ribosomes ne peuvent pas lire ces ARN)
Réplication et traduction :
- Entrée et décapsidation du virus dans la cellule hôte.→ possèdent des molécules d’ARN polymérase virale associéesau génome viral dans la particule (O)
- transcrit une première fois l'ARN - génomique comme modèle (-)
- Cette ARNpol transcrit l'ARN− en ARN+, qui sert :
- de matrice pour la traduction des protéines virales par les ribosomes de la cellule.
- de matrice pour la réplication du génome viral (via production de nouvelles copies d’ARN−).
Cela permet la production de nouvelles protéines et de nouveaux génomes pour assembler d’autres virus.

Grippe saisonnière :
- Provoque des épidémies annuelles :
- → 3 à 5 millions de cas graves / an
- → 250 000 à 500 000 décès dans le monde
- → 1 500 à 2 000 décès/an en France
- Chaque année, des variants différents circulent :
- 2007-08 : H3N2 touche + bébés & personnes âgées
- 2008-09 : H1N1 touche + bébés
- 2009-10 : H1N1 touche toutes les classes d’âge, surtout les bébés
Pandémie :
Provoquées par des virus mutants d’origine aviaire, via recombinaison avec des virus humains.
1918 – Grippe espagnole (H1N1) :
- ➤ 20 à 50 millions de morts dans le monde
- ➤ Surtout des surinfections bactériennes
1997 – Grippe de Hong Kong (H5N1) :
- ➤ Transmission depuis les oiseaux (élevages à Hong Kong)
- ➤ Nouvelle vague en Asie (2004–2005), devenue pandémie en 2006–2007
- ➤ Transmission longue distance par oiseaux migrateurs (ex : canards colverts)
► Type et hôte
Le type A est le plus fréquent chez l’humain, mais infecte aussi oiseaux et porcs.
Il existe plusieurs sous-types selon les protéines de surface :
- H = Hémagglutinine
- N = Neuraminidase ➤ Exemples : H1N1, H3N2
Variation génétique :
- Dérive antigénique : mutations mineures → grippes saisonnières.
►Mutations mineures touchant les séquences des protéines de surface qui sont modifiées de façon progressive→ modifie l’antigénicité= new souche (variants)
► ADN pol ne peut pas polymériser donc pas reconnue par le système immunitaire d'une année à l'autre
- Saut antigénique : recombinaisons majeures → pandémies (ex : H1N1, H3N2).
►Génome segmenté = incidence sur la variabilité génétique virale.
►changements du pouvoir pathogène (capacité à infecter) et de la virulence (niveau +/- fort de l’agression)
B) La covid-19
- Famille : Coronaviridae→ nouvelle souche = SARS-CoV-2 (« Syndrome Aigu Respiratoire Sévère –Coronavirus 2 »)
- réservoir naturel ( vecteur) = pangolin ou chauve souris
- Génome : ARN simple brin positif (ARNsb+), enveloppé
- Entrée via le récepteur ACE2
- Protéine Spike (S) essentielle à l’infection
- défense = stratégie vaccinale:
► vaccin à ARN : utilise la séquence génomique(ARNsb) du gène codant la protéine « Spike » du virus qui est « encapsidée » dans un transporteur lipidique

►Vaccin à adénovirus recombinant : Utilisation d’un adénovirus inoffensif (virus à ADN double brin) → vecteur viral. L’adénovirus est modifié génétiquement pour porter un gène du SARS-CoV-2, notamment celui de la protéine Spike. Permet d’introduire ce gène étranger ("transgène") dans le noyau des cellules humaines sans s'intégrer dans le génome humain. Etape du vaccin :
1.Construction du vecteur recombinant
➤ Le gène codant la protéine Spike est inséré dans le génome d’un adénovirus.
2.Injection et infection des cellules
➤ Le virus pénètre dans la cellule, se décapside, puis passe dans le noyau.
➤ Il exprime l’ARNm de la protéine Spike, sans s’intégrer dans l’ADN de l’hôte.
3.Réponse immunitaire
➤ La cellule produit la protéine Spike, qui déclenche une réponse immunitaire, comme avec les vaccins à ARN.
Stratégie face a la réponse immunitaire :Notre système immunitaire connaît déjà de nombreux adénovirus humains → risque qu'il détruise le vecteur avant qu’il agisse.
- AstraZeneca : utilise un adénovirus de chimpanzé (jamais vu par l’humain)
- Johnson & Johnson : utilise une souche humaine très rare
- Sputnik V : utilise deux adénovirus humains différents pour les deux doses, pour éviter que la 2ᵉ injection soit bloquée par l’immunité développée contre la 1ʳᵉ











