- En cédant un ion H+, un acide forme une base conjuguée
- L'acide et la base constituent alors un couple acide/base
Les acides et les bases
Définition
acide
espèce chimique capable de céder au moins un ion H+
base
espèce chimique capable de capter au moins un ion H+
Couple acide-base:
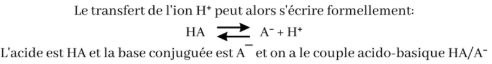
Une espèce chimique qui peut être acide ou base selon le couple est dite AMPHOTERE
Les acides carboxyliques
- Les acides carboxyliques sont des molécules organiques possédant un groupe caractéristique et a pour formule: R-COOH

Remarque:
L'ion carboxylate qui est la base de l'acide carboxylique possède un atome d'oxygène entourée de 3 doublets non liants
Couple des amines
- Une amine est un composé organique dérivé de l'ammoniac NH3 dont au moins un atome hydrogène a été remplacé par un groupe alkyle R.
- La formule des amines est :

Où R1, R2 et R3 représentent un groupe alkyle
La réaction acide-base
Définition
réaction acido-basique
fait intervenir deux couples acide/base. Au cours de cette réaction, la base d'un couple capte un proton cédé par l'acide de l'autre couple.

Le pH d'une solution
Définition
pH
grandeur sans dimension allant de 0 à 14 et qui est définie par la relation: pH=-log([H3O+]/C° où [H3O+] est la concentration en ions oxonium et elle s'exprime en mol/L et C° est appelée concentration standard C°=1mol/L
- Inversement, on peut connaître la concentration en ions oxonium à partir de la valeur du pH grâce à la relation:

- Ces relations ne sont valables que pour :[H3O+]<= 5,10-5


